|
2017-01-16 ChemHP X一MOL资讯
目前,关环复分解反应(ring-closing metathesis,RCM)已经成为构建大环骨架最重要的方法之一。立体选择性通常是该过程中必须考量的因素。RCM发展至今,Z型选择性大环化复分解反应已经取得了不少突破性进展,而E型选择性大环化复分解则发展相对滞后,目前唯一可行的策略是对混合物通过乙烯醇分解Z型产物来得到E型产物。近期,美国波士顿学院的Amir H. Hoveyda教授等人在Nature上报道实现了动力学E型选择性大环化复分解反应。该文第一作者是2013年毕业于中科院上海有机所的沈晓(Xiao Shen)博士(博士导师为胡金波研究员)。
通过对发展相对成熟的E-型烯烃交叉复分解的思考,作者考虑从一端是α-烯烃、另一端是E型的1,2-二取代烯烃的二烯出发,烯烃上的R取代基则非常重要。生成E型RCM则需要反应中四元环钼物种II的形成比III有利(Scheme 1a)。
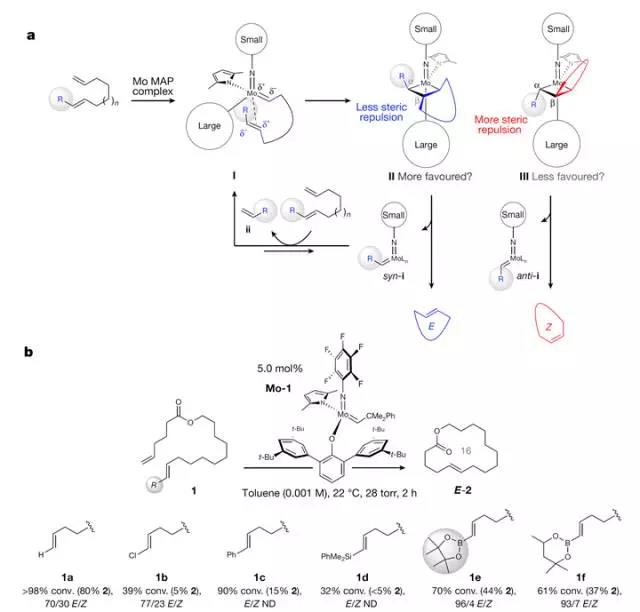
Scheme 1. 设计策略和理想取代基。图片来源:Nature
作为起始原料的E型烯烃,需满足以下六个要求:1)需容易获得,而且至少有98%E型比例;2)烯烃需含有位阻或电性的特征,避免其异构化;3)烯烃上的取代基R也不能太大,否则很难发生RCM反应;4)取代基能稳定邻近的Mo=C键的累积电子云密度;5)syn-1中的Mo=C键需存活周期较长,能促进催化剂不断转化,但活性也不能太高,否则容易发生复分解异构化或导致中间体分解;6)之前提到的利用R基团稳定syn-1,必须权衡考虑使RCM以一个理想的速率进行。随后,作者对R基团进行了考察(Scheme 1b)。结果发现,在使用Bpin取代的烯烃1e出发时,可以取得最佳条件。反应以70%的转化率、44%的产率和E/Z比为96/4的结果得到产物E-2。反应产率高,区域选择性和立体选择性均非常好。
在确定Bpin作为最佳取代基团后,作者对大环RCM反应的底物范围进行了考究(Scheme 2)。从炔烃3出发,经由简单的硼氢化、酯化可以得到E型选择性的烯烃,而后发生RCM反应得到大环内酯化的产物。根据这样的思路,12-19元大环骨架都可以顺利构建(Scheme 2a)。为了得到大环内酰胺的底物,作者从骨架9出发,经由Cu(NHC)催化的硼氢化得到11,而后发生RCM反应得到产物(Scheme 2b)。对于每一个RCM反应,作者都比较了本文的钼催化剂与过去报道的Ru-1和Ru-2催化剂,结果发现Ru-1和Ru-2催化剂也可以发生RCM反应,但产物的E型选择性比钼催化剂差。
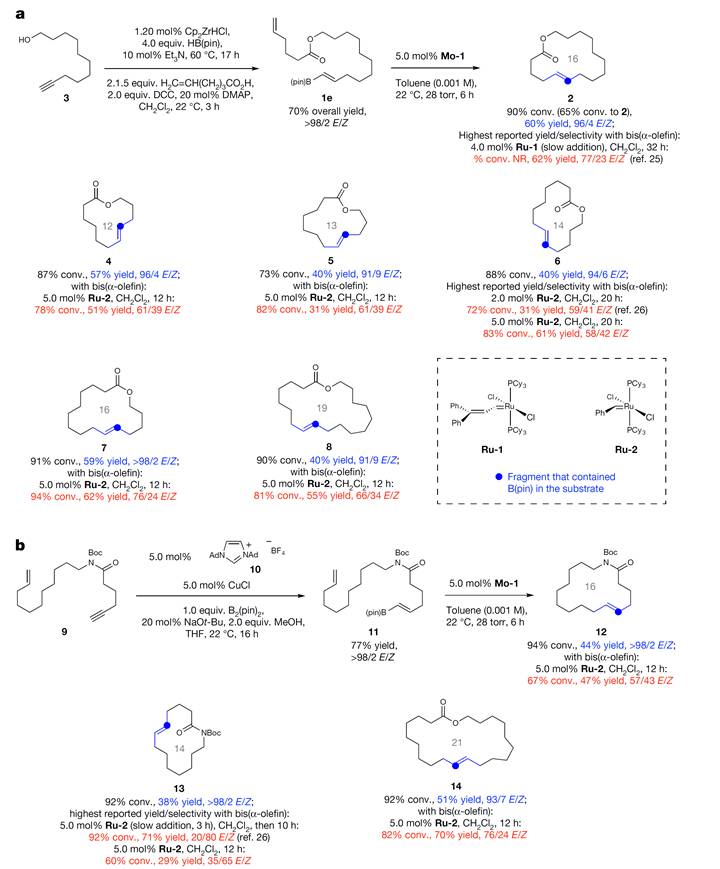
Scheme 2. E型选择性大环化复分解反应的底物扩展。图片来源:Nature
为了证明该方法报道的E型大环内酯化在实际中的应用,作者将该方法应用于recifeiolide(十二元环的抗生素)和pacritinib(十八元环的酶抑制剂)的合成中。Recifeiolide在过去的报道中,可以通过Ru催化的方法以80%收率和E/Z(82/18)的选择性获得。反应操作繁琐,需滴加20 h,非常不利于实际应用(Scheme 3a)。作者用本文发展的策略,成功地以65%收率和E/Z(98/2)得到recifeiolide,并且操作大大简化。值得一提的是,作者发现使用石蜡球包裹的钼催化剂时,反应仍然能以很好的产率和选择性得到recifeiolide。当使用酯基氧的α位没有甲基的底物时,反应产率有所降低,但E型选择性仍然很好,这比Ru-2作催化剂好很多(Scheme 3b)。
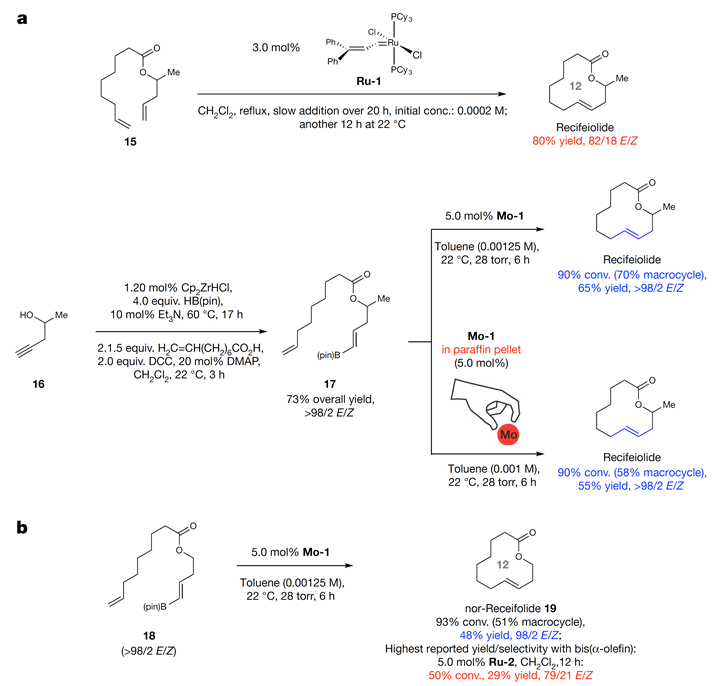
Scheme 3. 立体合成recifeiolide中的应用。图片来源:Nature
作者随后考虑用该方法合成pacritinib分子。过去通过Ru催化的RCM反应合成关键中间体21的E型选择性一般,而且溶液要求很稀(0.001 M)。采用本文发展的条件,产率只有17%,但E/Z选择性高达93/7。加入一当量B(C6F5)3作添加剂时,反应产率可升到60%,E/Z选择性高达95/5。难得的是,该反应浓度可达0.2 M,所需溶剂是原先报道的1/20,这更有利于该反应在实际中应用。从底物24出发时,即使加入添加剂B(C6F5)3,Mo催化的结果只能获得34%的收率,但E/Z选择性仍然高达93/7。作者考虑芳环侧链的两个O原子对钼有配位作用,从而降低了催化剂的活性,而配位作用可能是来源于芳环上NH的电子云密度离域。于是,作者考虑将底物中的NH用Boc保护参与反应,而后脱除。事实证明,该设想是正确的,产率从34%提升至73%,而且无需添加剂B(C6F5)3,同时E/Z选择性基本不变。
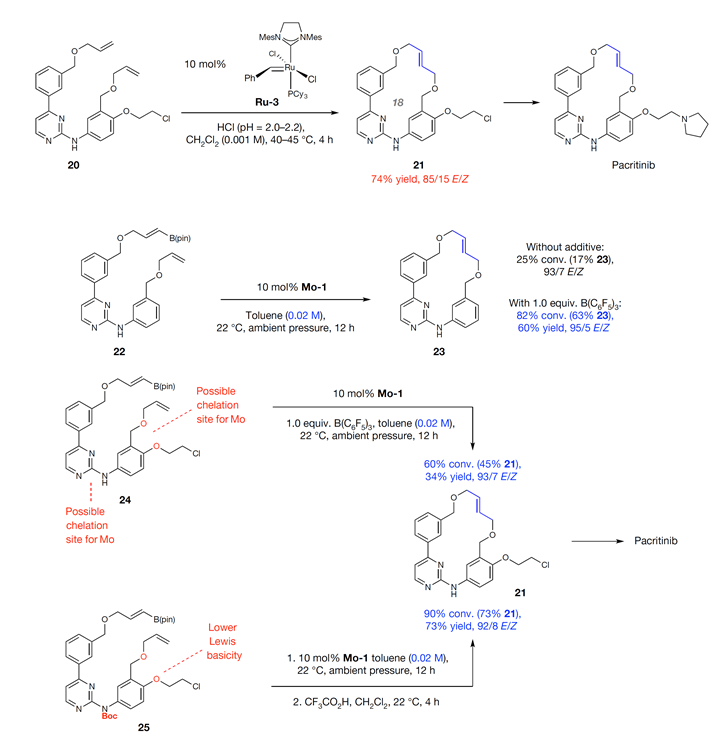
Scheme 4. 立体合成pacritinib中的应用。图片来源:Nature
—— 总结 ——
在该工作,Hoveyda等人基于对烯烃结构的思考与探索,发现了取代基团Bpin对E型选择性大环RCM反应的影响,发展了钼催化的E型选择性大环RCM反应。该反应操作简单,条件温和,室温即可进行,产率高,区域选择性和立体选择性好。此外,作者还将该催化体系与过去报道使用的Ru催化剂进行了比较,显示了该体系的优越性。更加值得一提的是,作者还将该方法成功于药物分子recifeiolide(抗生素)和pacritinib(酶抑制剂)的合成中,这进一步证明了该方法的实用性。
阅读原文
|

