|
精准医学的胜利!罗氏新药今日获突破性疗法认定
2017-08-08 药明康德
今日,罗氏(Roche)集团公司基因泰克(Genentech)宣布,美国FDA已经接受了Zelboraf(vemurafenib)的补充新药申请(sNDA),用于治疗带有BRAF V600突变的埃德海姆⁃切斯特病(Erdheim-Chester disease)。值得一提的是,美国FDA同时授予该药治疗此项适应症的突破性疗法认定,以及优先审评资格。如果一切顺利,这款新药将在今年12月7日前获批扩大适应症。
埃德海姆⁃切斯特病是一种极为罕见的疾病,会造成异常组织增生,并影响到骨骼、心脏、大脑等器官。根据现有的数据,全美的病例数不足500。其中,超过一半的患者带有BRAF V600突变。由于该疾病如此罕见,目前尚没有一款疗法能够治疗这些患者。
由罗氏与Plexxikon(现属于第一三共株式会社集团,Daiichi Sankyo Group)带来的vemurafenib是一款能抑制部分突变BRAF蛋白的抑制剂。BRAF蛋白在控制细胞生长和生存的信号通路中起到了非常关键的作用。一旦它发生突变,就会引起细胞异常生长,甚至是让细胞癌变,导致肿瘤。Vemurafenib是同类药物中首个获批的新药,有望能抑制突变的BRAF蛋白,从而控制病情。
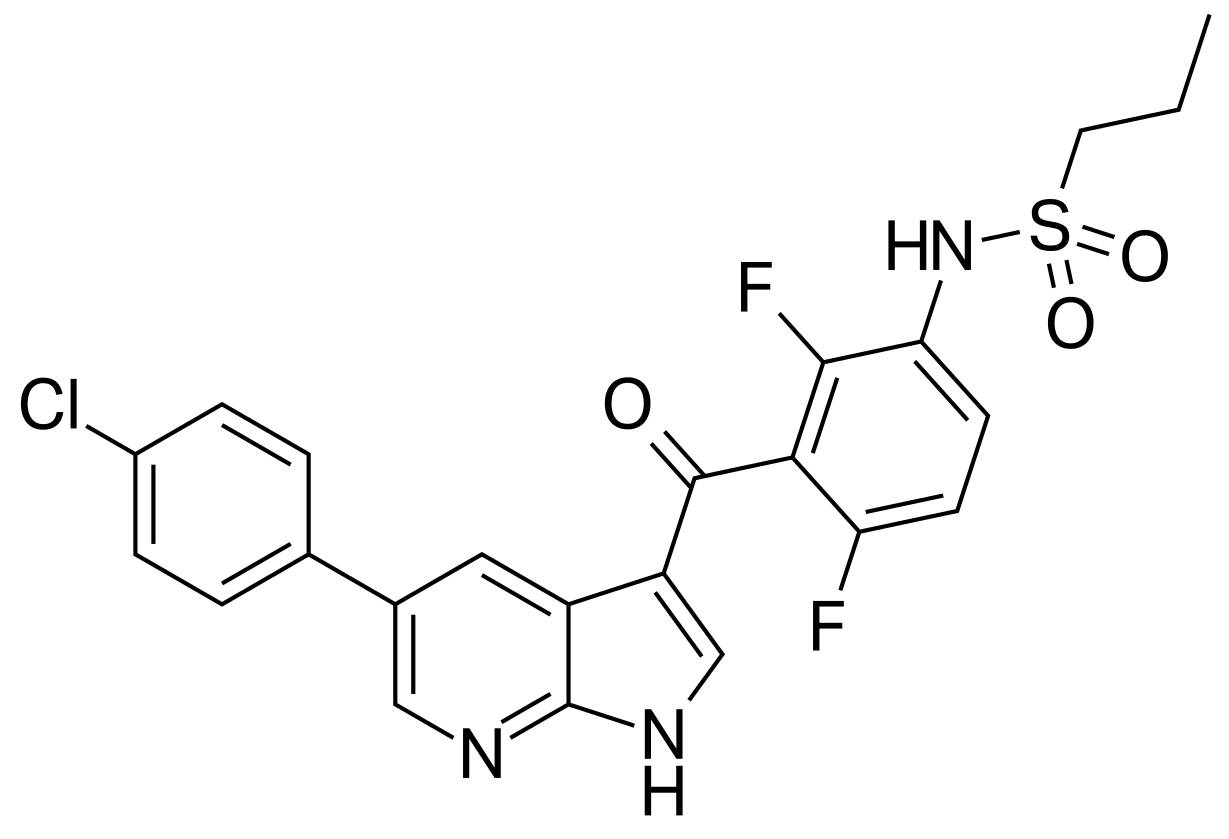
▲Vemurafenib的分子结构式(图片来源:维基百科)
在一项非随机的2期“篮子”临床试验中,研究人员评估了vemurafenib治疗BRAF V600突变的癌症患者与其他疾病患者的效果。在这些患者中,有22名患有埃德海姆⁃切斯特病。研究表明,这些患者得到的最佳总体缓解率为54.5%。它的常见副作用也在预期之内。基于这些结果,美国FDA为其颁发了突破性疗法认定,与优先审评资格。
“这是首个向FDA递交的埃德海姆⁃切斯特病潜在疗法。通过一个充满创新的临床试验,我们在基因突变相同,但疾病类型不同的患者中检验了Zelboraf的效果,”罗氏首席医学官和全球产品开发负责人Sandra Horning博士说:“我们承诺为罕见病患者带来全新疗法,并希望Zelboraf能尽快获批治疗这种疾病。”
美国FDA的认可,表明了“篮子”试验的潜力。作为一种创新临床试验设计,它能更快获取所需的数据,加速创新疗法的开发。相信在这个精准医学的时代,更多“篮子”试验带来的新药能够上市,更精准地为患者带来福音。
参考资料:
[1] FDA Grants Priority Review and Breakthrough Therapy Designation for Zelboraf (vemurafenib) in Erdheim-Chester Disease with BRAF V600 Mutation
[2] 基因泰克官方网站
阅读原文
|

